Zhvillimi i ideve për strukturën e atomit. Përvoja e Rutherford. Modeli i atomit i Radhërfordit. Postulatet e Bohr-it. Teoria e Bohr-it për atomin e hidrogjenit. Historia e zhvillimit të doktrinës së strukturës së atomit Ide për strukturën e atomit
Ernest Rutherford dhe Niels Bohr luajtën një rol të veçantë në krijimin e teorisë moderne të strukturës atomike. Në vitin 1911, Rutherford, duke kryer eksperimente për bombardimin e fletës metalike me grimca α, zbuloi se grimcat e rënda, të quajtura më vonë bërthama, ndodhen brenda atomeve, dhe ai gjithashtu propozoi një model planetar të strukturës së atomit. Dhe në 1913, Bohr parashtroi teorinë e parë kuantike të atomit.
Pra, një atom është një mikrosistem kompleks i përbërë nga grimca elementare. Ai përbëhet nga një bërthamë e ngarkuar pozitivisht dhe elektrone të ngarkuar negativisht. Bartësi i ngarkesës pozitive të bërthamës është protoni. Bërthamat e atomeve të të gjithë elementëve, përveç izotopit të lehtë të hidrogjenit, përfshijnë protonet dhe neutronet.
Bërthama është baza themelore e atomit, përcakton individualitetin e elementeve dhe përbëhet nga nukleone.
Rrezet atomike janë 0,05 – 0,30 nm. Masa e një elektroni është shumë më e vogël se masa e nukleoneve, kështu që masa e një atomi është afërsisht e barabartë me masën e bërthamës.
Vetitë e bërthamës përcaktohen kryesisht nga përbërja e saj. Numri i protoneve - ngarkesa e bërthamës, karakterizon përkatësinë e atomit në një element të caktuar kimik. Një karakteristikë tjetër e rëndësishme e bërthamës është numri i masës A:
A = Z + N, ku N është numri i përgjithshëm i neutroneve; Z është numri i përgjithshëm i protoneve.
Quhen atomet me numër të ndryshëm të protoneve dhe neutroneve, por me të njëjtën A izobaret.
Quhen atomet me të njëjtin numër protonesh, pra të njëjtën ngarkesë bërthamore izotopet .
Quhen atomet me të njëjtin numër neutronesh izotoneve.
Bazuar në përcaktimin e izotopeve, mund të jepet një përkufizim më modern i një elementi kimik. Element kimik është një lloj atomi i karakterizuar nga një ngarkesë e caktuar bërthamore.
Në kimi, bërthama atomike konsiderohet të jetë një pikë që ka një ngarkesë pozitive + Z dhe një masë të shprehur me numrin masiv A. Megjithatë, bërthama është një grimcë që ka strukturën e saj. Sipas teorisë moderne, bërthama atomike ka një strukturë guaskë. Protonet dhe neutronet zënë në mënyrë të pavarur shtresat dhe nënshtresat bërthamore, ashtu siç vërehet për elektronet në shtresën elektronike të një atomi.
Një krahasim tregon se masa e bërthamës është gjithmonë më e vogël se shuma aritmetike e masave të protoneve dhe neutroneve që përbëjnë përbërjen e saj. Diferenca ndërmjet këtyre sasive quhet defekt masiv. Defekti i masës korrespondon me energjinë që lirohet gjatë formimit të një bërthame nga protonet dhe neutronet e lira, dhe mund të llogaritet nga relacioni i Ajnshtajnit E = mc 2. Kjo energji lidhëse nukleone në bërthamë, është miliona herë më e lartë se energjia lidhëse e atomeve në një molekulë. Prandaj, gjatë shndërrimeve kimike të substancave, bërthamat atomike nuk ndryshojnë.
Duhet të theksohet se natyra e forcave bërthamore nuk është sqaruar plotësisht; ato veprojnë në distanca shumë të shkurtra (rreth 10-15 metra) dhe lidhin protone dhe neutrone individuale, duke formuar bërthama të mëdha. Aktualisht njihen rreth 300 bërthama të qëndrueshme dhe mbi 1400 bërthama radioaktive.
Siç kemi zbuluar tashmë, bërthamat e atomeve nuk preken gjatë reaksioneve kimike, prandaj vetitë kimike të elementeve varen kryesisht nga numri dhe vendndodhja e elektroneve në atomet e tyre.
Elektroniështë një grimcë jashtëzakonisht e lehtë e ngarkuar negativisht që u zbulua në 1897 gjatë eksperimenteve me rrezet katodike.
Në vitin 1913, Niels Bohr zhvilloi një model të atomit. Teoria e tij e strukturës atomike bazohej në dy dispozita të quajtura postulatet e Bohr-it.
Postulati i parë: elektronet lëvizin rreth bërthamës së një atomi në orbita rrethore. Sa më afër bërthamës të jetë orbita e elektronit, aq më e vogël është rezerva energjetike e atomit, pasi me zvogëlimin e distancës ndërmjet dy ngarkesave elektrike të shenjave të ndryshme, energjia totale e tyre zvogëlohet.
Bohr sugjeroi se në një atom elektronet mund të lëvizin vetëm në orbita të caktuara (që nënkupton distancën nga bërthama), të cilat quhen lejohet . Çdo orbitë elektroni korrespondon me një energji të caktuar të atomit. Një elektron mund të lëvizë nga orbita në orbitë vetëm në kërcime. Energjia e atomit gjithashtu ndryshon befas; energjia thuhet se është e kuantizuar.
Postulati i dytë Shtetet që momenti këndor (momenti mv) i një elektroni në orbitën e tij është i natyrës kuantike dhe është i barabartë me një shumëfish të plotë të h/2π(h – konstanta e Planck-ut, h = 6,63 ∙ 10 -34 J∙ s).
Dega e fizikës që studion strukturën e brendshme të atomeve. Atomet, që fillimisht mendohej se ishin të pandashëm, janë sisteme komplekse. Ata kanë një bërthamë masive të protoneve dhe neutroneve, rreth së cilës elektronet lëvizin në hapësirën boshe. Atomet janë shumë të vogla - dimensionet e tyre janë rreth 10 –10 –10 –9 m, dhe dimensionet e bërthamës janë ende rreth 100,000 herë më të vogla (10 –15 –10 –14 m). Prandaj, atomet mund të "shihen" vetëm në mënyrë indirekte, në një imazh me zmadhim shumë të lartë (për shembull, duke përdorur një projektor me emetim në terren). Por edhe në këtë rast atomet nuk mund të shihen në detaje. Njohuritë tona për strukturën e tyre të brendshme bazohen në një sasi të madhe të dhënash eksperimentale, të cilat në mënyrë indirekte por bindëse mbështesin sa më sipër.
Idetë për strukturën e atomit ndryshuan rrënjësisht në shekullin e 20-të. ndikuar nga idetë e reja teorike dhe të dhënat eksperimentale. Ka ende pyetje të pazgjidhura në përshkrimin e strukturës së brendshme të bërthamës atomike, të cilat janë objekt i një kërkimi intensiv. Seksionet e mëposhtme përshkruajnë historinë e zhvillimit të ideve rreth strukturës së atomit në tërësi; një artikull i veçantë i kushtohet strukturës së bërthamës ( STRUKTURA E Bërthamës ATOMIKE), pasi këto ide u zhvilluan kryesisht në mënyrë të pavarur. Energjia e nevojshme për të studiuar shtresën e jashtme të një atomi është relativisht e vogël, në rendin e energjisë termike ose kimike. Për këtë arsye, elektronet u zbuluan eksperimentalisht shumë përpara zbulimit të bërthamës.
Bërthama, megjithë madhësinë e saj të vogël, është e lidhur shumë fort, kështu që mund të shkatërrohet dhe studiohet vetëm me ndihmën e forcave miliona herë më intensive se forcat që veprojnë midis atomeve. Përparimi i shpejtë në kuptimin e strukturës së brendshme të bërthamës filloi vetëm me ardhjen e përshpejtuesve të grimcave. Është ky ndryshim i madh në madhësi dhe energji lidhëse që na lejon të konsiderojmë strukturën e atomit në tërësi veçmas nga struktura e bërthamës.
Për të marrë një ide për madhësinë e një atomi dhe hapësirën boshe që ai zë, merrni parasysh atomet që përbëjnë një pikë uji me diametër 1 mm. Nëse e zgjeroni mendërisht këtë pikë në madhësinë e Tokës, atëherë atomet e hidrogjenit dhe oksigjenit të përfshirë në molekulën e ujit do të kenë një diametër prej 1-2 m. Pjesa më e madhe e masës së çdo atomi është e përqendruar në thelbin e tij, diametri prej të cilave ishte vetëm 0.01 mm.
Historia e shfaqjes së ideve më të përgjithshme për atomin zakonisht daton që nga koha e filozofit grek Demokritus (rreth 460 - rreth 370 p.e.s.), i cili mendoi shumë për grimcat më të vogla në të cilat mund të ndahej çdo substancë. . Një grup filozofësh grekë që kishin mendimin se ekzistonin grimca të tilla të vogla të pandashme quheshin atomistë. Filozofi grek Epikuri (rreth 342–270 p.e.s.) pranoi teorinë atomike dhe në shekullin e parë p.e.s. një nga ndjekësit e tij, poeti dhe filozofi romak Lucretius Carus, përshkroi mësimet e Epikurit në poemën "Mbi natyrën e gjërave", falë së cilës u ruajt për brezat pasardhës. Aristoteli (384–322 p.e.s.), një nga shkencëtarët më të mëdhenj të antikitetit, nuk e pranoi teorinë atomike dhe pikëpamjet e tij mbi filozofinë dhe shkencën mbizotëruan më pas në të menduarit mesjetar. Teoria atomiste nuk dukej se ekzistonte deri në fundin e Rilindjes, kur arsyetimi filozofik thjesht spekulativ u zëvendësua nga eksperimenti.
Gjatë Rilindjes, filloi kërkimi sistematik në fushat që tani quhen kimi dhe fizikë, duke sjellë me vete njohuri të reja mbi natyrën e "grimcave të pandashme". R. Boyle (1627-1691) dhe I. Newton (1643-1727) e bazuan arsyetimin e tyre në idenë e ekzistencës së grimcave të pandashme të materies. Sidoqoftë, as Boyle dhe as Njutoni nuk kishin nevojë për një teori të detajuar atomike për të shpjeguar fenomenet që i interesonin, dhe rezultatet e eksperimenteve të tyre nuk zbuluan asgjë të re në lidhje me vetitë e "atomeve".
STRUKTURA ATOMIKELigjet e Daltonit. Vërtetimi i parë vërtet shkencor i teorisë atomike, i cili demonstroi bindshëm racionalitetin dhe thjeshtësinë e hipotezës se çdo element kimik përbëhet nga grimcat më të vogla, ishte puna e mësuesit të matematikës në shkollën angleze J. Dalton (1766–1844), artikulli i të cilit kushtuar këtij problemi u shfaq në 1803 .
Dalton studioi vetitë e gazeve, në veçanti raportin e vëllimeve të gazrave që reaguan për të formuar një përbërje kimike, për shembull, në formimin e ujit nga hidrogjeni dhe oksigjeni. Ai vërtetoi se raportet e sasive të reaguara të hidrogjenit dhe oksigjenit janë gjithmonë raporte të numrave të plotë të vegjël. Kështu, kur formohet uji (H 2 O), 2.016 g gaz hidrogjen reagon me 16 g oksigjen dhe kur formohet peroksid hidrogjeni (H 2 O 2), 32 g gaz oksigjen reagon me 2.016 g hidrogjen. Masat e oksigjenit që reagojnë me të njëjtën masë hidrogjeni për të formuar këto dy komponime janë të lidhura me njëra-tjetrën si numra të vegjël:
Bazuar në këto rezultate, Dalton formuloi "ligjin e tij të raporteve të shumëfishta". Sipas këtij ligji, nëse dy elementë bashkohen në përmasa të ndryshme për të formuar përbërje të ndryshme, atëherë masat e njërit prej elementeve të kombinuara me të njëjtën sasi të elementit të dytë lidhen si numra të plotë të vegjël. Sipas ligjit të dytë të Daltonit, "ligji i raporteve konstante", në çdo përbërje kimike raporti i masave të elementeve të tij përbërës është gjithmonë i njëjtë. Një sasi e madhe të dhënash eksperimentale, që lidhen jo vetëm me gazet, por edhe me lëngjet dhe përbërjet e ngurta, u mblodhën nga J. Berzelius (1779-1848), i cili bëri matje të sakta të masave reaguese të elementeve për shumë përbërje. Të dhënat e tij konfirmuan ligjet e formuluara nga Dalton dhe demonstruan bindshëm se çdo element ka një njësi më të vogël të masës.
Postulatet atomike të Dalton-it kishin avantazhin ndaj arsyetimit abstrakt të atomistëve të lashtë grekë se ligjet e tij bënë të mundur shpjegimin dhe lidhjen e rezultateve të eksperimenteve reale, si dhe parashikimin e rezultateve të eksperimenteve të reja. Ai postuloi se 1) të gjithë atomet e të njëjtit element janë identikë në të gjitha aspektet, në veçanti, masat e tyre janë të njëjta; 2) atomet e elementeve të ndryshëm kanë veti të ndryshme, në veçanti, masat e tyre janë të ndryshme; 3) një përbërje, ndryshe nga një element, përmban një numër të caktuar të atomeve të secilit prej elementeve të tij përbërës; 4) në reaksionet kimike, mund të ndodhë një rishpërndarje e atomeve, por asnjë atom i vetëm nuk shkatërrohet ose krijohet përsëri. (Në fakt, siç doli në fillim të shekullit të 20-të, këto postulate nuk janë përmbushur rreptësisht, pasi atomet e të njëjtit element mund të kenë masa të ndryshme, për shembull, hidrogjeni ka tre lloje të tilla, të quajtura izotope; përveç kësaj, atomet mund të pësojë transformime radioaktive dhe madje të shembet plotësisht, por jo në reaksionet kimike të konsideruara nga Daltoni.) Bazuar në këto katër postulate, teoria atomike e Dalton dha shpjegimin më të thjeshtë të ligjeve të raporteve konstante dhe të shumëfishta.
Edhe pse ligjet e Daltonit qëndrojnë në themel të gjithë kimisë, ato nuk përcaktojnë madhësitë dhe masat aktuale të atomeve. Ata nuk thonë asgjë për numrin e atomeve që përmbahen në një masë të caktuar të një elementi ose përbërjeje. Molekulat e substancave të thjeshta janë shumë të vogla për t'u peshuar individualisht, kështu që duhet të përdoren metoda indirekte për të përcaktuar masat e atomeve dhe molekulave.
Numri i Avogadros. Në 1811, A. Avogadro (1776-1856) parashtroi një hipotezë që thjeshtoi shumë analizën se si formohen komponimet nga elementët dhe vendosi dallimin midis atomeve dhe molekulave. Ideja e tij ishte se vëllimet e barabarta të gazeve në të njëjtën temperaturë dhe presion përmbajnë të njëjtin numër molekulash. Në parim, një aluzion i kësaj mund të gjendet në punën e mëparshme të J. Gay-Lussac (1778-1850), i cili vërtetoi se raporti i vëllimeve të elementeve të gaztë që hyjnë në një reaksion kimik shprehet në numra të plotë, megjithëse të ndryshëm. nga raportet e masës të marra nga Daltoni. Për shembull, 2 litra gaz hidrogjen (molekula H 2), duke u kombinuar me 1 litër gaz oksigjen (molekula O 2), formojnë 1 litër avull uji (molekula H 2 O).
Numri i vërtetë i molekulave në një vëllim të caktuar gazi është jashtëzakonisht i madh dhe deri në vitin 1865 nuk mund të përcaktohet me saktësi të pranueshme. Sidoqoftë, tashmë në kohën e Avogadro-s, u bënë vlerësime të përafërta bazuar në teorinë kinetike të gazeve. Një njësi shumë e përshtatshme për matjen e sasisë së një lënde është nishani, d.m.th. sasia e një lënde në të cilën ka aq molekula sa atome në 0,012 kg të izotopit më të zakonshëm të karbonit 12 C. Një mol i një gazi ideal në kushte normale (n.s.), d.m.th. temperatura dhe presioni standard, zë një vëllim prej 22.4 litra. Numri i Avogadro është numri i përgjithshëm i molekulave në një mol të një substance ose në 22,4 litra gaz në kushte ambienti. Metoda të tjera, si radiografia, japin numrin Avogadro N 0 vlera më të sakta se ato të marra në bazë të teorisë kinetike. Vlera e pranuar aktualisht është 6,0221367×10 23 atome (molekula) në një mol. Rrjedhimisht, 1 litër ajër përmban afërsisht 3×10 22 molekula oksigjen, azot dhe gazra të tjerë.
Roli i rëndësishëm i numrit të Avogadro për fizikën atomike është për faktin se ai lejon që dikush të përcaktojë masën dhe dimensionet e përafërta të një atomi ose molekule. Meqenëse masa e 22,4 litrave gaz H2 është 2,016×10 –3 kg, masa e një atomi hidrogjeni është 1,67×10 –27 kg. Nëse supozojmë se në një trup të ngurtë atomet janë të vendosura afër njëri-tjetrit, atëherë numri i Avogadro do të na lejojë të vlerësojmë afërsisht rrezen r, le të themi, atomet e aluminit. Për aluminin, 1 mol është i barabartë me 0,027 kg, dhe dendësia është 2,7H103 kg/m3. Në këtë rast kemi
Deri në fund të shekullit të 19-të, shumica e shkencëtarëve përfaqësonin atomin si një grimcë të pazbërthyeshme dhe të pandashme të një elementi - "nyja përfundimtare" e materies. Besohej gjithashtu se atomet janë të pandryshueshme: një atom i një elementi të caktuar në asnjë rrethanë nuk mund të shndërrohet në një atom të ndonjë elementi tjetër.
Fundi i shekullit të 19-të dhe fillimi i shekullit të 20-të u karakterizuan nga zbulime të reja në fizikë dhe kimi, të cilat ndryshuan pikëpamjen e atomit si një grimcë e pandryshueshme, duke dëshmuar për përbërjen komplekse të atomeve dhe mundësinë e ndërthurjeve të tyre.
Këtu përfshihet, para së gjithash, zbulimi i elektronit nga fizikani anglez Thomson në 1897, zbulimi dhe studimi i radioaktivitetit në fund të viteve '90 të shekullit të 19-të. A. Becquerel, Marie dhe Pierre Curie, E. Rutherford.
Rreth fillimit të shekullit të njëzetë. Studimet e një numri fenomenesh (rrezatimi nga trupat e nxehtë, efekti fotoelektrik, spektrat atomike) çuan në përfundimin se energjia shpërndahet dhe transmetohet, absorbohet dhe emetohet jo vazhdimisht, por në mënyrë diskrete, në pjesë të veçanta - kuante. Energjia e një sistemi mikrogrimcash mund të marrë gjithashtu vetëm vlera të caktuara, të cilat janë shumëfisha të numrit të kuanteve.
Supozimi i energjisë kuantike u bë për herë të parë nga M. Planck (1900). Energjia e kuantit E është proporcionale me frekuencën e rrezatimit ν:
ku h është konstanta e Plankut (6,626 10 -34 J×s), ν=, s është shpejtësia e dritës, l është gjatësia e valës.
Në vitin 1905, A. Ajnshtajni parashikoi se çdo rrezatim është një rrymë kuantesh energjie, të quajtura fotone. Nga teoria e Ajnshtajnit rezulton se drita ka një natyrë të dyfishtë.
Në vitin 1911, Rutherford propozoi një model planetar bërthamor të një atomi, i përbërë nga një bërthamë e rëndë rreth së cilës rrotullohen elektronet, si planetët e sistemit diellor. Sidoqoftë, siç tregon teoria e fushës elektromagnetike, elektronet në këtë rast duhet të lëvizin në një spirale, duke lëshuar vazhdimisht energji dhe të bien në bërthamë.
Shkencëtari danez N. Bohr, duke përdorur modelin Rutherford dhe teorinë e Planck, propozoi modelin e parë kuantik (1913) të strukturës së atomit të hidrogjenit, sipas të cilit elektronet lëvizin rreth bërthamës jo në asnjë, por vetëm në orbita të lejuara, në të cilat elektroni ka energji të caktuara. Kur një elektron lëviz nga një orbitë në tjetrën, atomi thith ose lëshon energji në formën e kuanteve. Teoria e Bohr bëri të mundur llogaritjen e energjisë së elektroneve, vlerat e kuanteve të energjisë të emetuara gjatë kalimit të një elektroni nga një nivel në tjetrin. Ajo jo vetëm që shpjegoi natyrën fizike të spektrave atomike si rezultat i kalimit të elektroneve nga një orbitë e palëvizshme në tjetrën, por gjithashtu bëri të mundur për herë të parë llogaritjen e spektrit. Llogaritja e Bohr-it e spektrit të atomit më të thjeshtë, atomit të hidrogjenit, dha rezultate të shkëlqyera: pozicioni i llogaritur i vijave spektrale në pjesën e dukshme të spektrit përkonte me vendndodhjen e tyre aktuale në spektër. Por teoria e Bohr-it nuk mund të shpjegonte sjelljen e një elektroni në një fushë magnetike dhe të gjitha linjat spektrale atomike doli të ishin të papërshtatshme për atomet multielektronike. Kishte nevojë për një model të ri të atomit, bazuar në zbulimet në mikrokozmos.
2.3. Modeli kuanto-mekanik i atomit të hidrogjenit. Konceptet fillestare të mekanikës kuantike
Në vitin 1924 Louis de Broglie (Francë) sugjeroi se elektroni, si mikrogrimcat e tjera, karakterizohet nga dualiteti grimcë-valë. De Broglie propozoi një ekuacion që lidh gjatësinë e valës λ të një elektroni ose ndonjë grimce tjetër me masë m dhe shpejtësi v:
De Broglie i quajti valët e grimcave të materies valë materiale. Ato janë karakteristike për të gjitha grimcat ose trupat, por, siç vijon nga ekuacioni, për makrotrupat gjatësia e valës është aq e vogël sa që aktualisht nuk mund të zbulohet. Pra, për një trup me masë 1000 kg që lëviz me shpejtësi 108 km/h (30 m/s), λ = 2,21 10 -38 m.
Hipoteza e De Broglie u konfirmua eksperimentalisht nga zbulimi i efekteve të difraksionit dhe ndërhyrjes së rrjedhës së elektroneve. Aktualisht, difraksioni i flukseve të elektroneve, neutroneve dhe protoneve përdoret gjerësisht për të studiuar strukturën e substancave.
Në vitin 1927 W. Heisenberg (Gjermani) postuloi parimin e pasigurisë, sipas të cilit pozicioni dhe momenti i një grimce nënatomike (mikrogrimca) është thelbësisht e pamundur të përcaktohet në çdo kohë me saktësi absolute. Në çdo kohë të caktuar, vetëm një nga këto veti mund të përcaktohet. E. Schrödinger (Austri) më 1926 nxori një përshkrim matematikor të sjelljes së një elektroni në një atom. Thelbi i tij qëndron në faktin se lëvizja e elektroneve në një atom përshkruhet nga një ekuacion valor, dhe vendndodhja e elektronit përcaktohet sipas parimeve probabiliste. Ekuacioni i Shrodingerit, i cili është baza e teorisë moderne mekanike kuantike të strukturës atomike, ka formën (në rastin më të thjeshtë):
– (+ + ) + U= E,
ku h është konstanta e Planck; m – masa e grimcave; U – energjia potenciale; E – energjia totale; x, y, z – koordinatat; ψ është funksioni valor.
Funksioni valor ψ ka rëndësi të veçantë për karakterizimin e gjendjes së elektronit. Katrori i tij – ψ 2 – ka një kuptim të caktuar fizik. Vlera ψ 2 dv shpreh probabilitetin e gjetjes së një elektroni në vëllimin e hapësirës dv që rrethon bërthamën atomike. Aktualisht, ekuacioni ka një zgjidhje të saktë vetëm për hidrogjenin dhe grimcat e ngjashme me hidrogjenin He +, Li 2 +, d.m.th. për grimcat me një elektron. Zgjidhja e këtij ekuacioni është një detyrë komplekse dhe shqyrtimi i saj është përtej qëllimit të këtij kursi.
Punimet e Planck, Einstein, Bohr, de Broglie, Heisenberg dhe Schrödinger hodhën themelet për mekanikën kuantike, e cila studion lëvizjen dhe ndërveprimin e mikrogrimcave. Ai bazohet në konceptin e energjisë kuantike, natyrën valore të lëvizjes së mikrogrimcave dhe metodën probabiliste (statistikore) të përshkrimit të mikroobjekteve.
Fundi i punës -
Kjo temë i përket seksionit:
kimia e përgjithshme
Institucioni shtetëror arsimor i arsimit të lartë profesional.. Universiteti Shtetëror i Naftës dhe Gazit Tyumen..
Nëse keni nevojë për materiale shtesë për këtë temë, ose nuk keni gjetur atë që po kërkoni, ju rekomandojmë të përdorni kërkimin në bazën e të dhënave tona të veprave:
Çfarë do të bëjmë me materialin e marrë:
Nëse ky material ishte i dobishëm për ju, mund ta ruani në faqen tuaj në rrjetet sociale:
| Tweet |
Të gjitha temat në këtë seksion:
kimia e përgjithshme
Kursi i leksioneve Tyumen 2005 UDC 546(075) Sevastyanova G.K., Karnaukhova T.M. Kimi e përgjithshme: Kursi i leksioneve. – Tyumen: TyumGNGU, 2005. – 210 f.
Ligjet themelore të kimisë
1. Ligji i ruajtjes së masës së substancave (M.V. Lomonosov; 1756): masa e substancave që hyjnë në një reaksion është e barabartë me masën e substancave të formuara si rezultat i reaksionit. 2. Për
Dispozitat e përgjithshme
Sipas koncepteve moderne, një atom është grimca më e vogël e një elementi kimik, i cili është bartës i vetive të tij kimike. Një atom është elektrikisht neutral dhe përbëhet nga një ngarkesë pozitive
Modeli i gjendjes së një elektroni në një atom
Në përputhje me konceptet mekanike kuantike, një elektron është një formacion që sillet edhe si grimcë edhe si valë, d.m.th. ajo ka, si mikrogrimcat e tjera, korpuskula
Numrat kuantikë
Për të karakterizuar sjelljen e një elektroni në një atom, u prezantuan numrat kuantikë: kryesorë, orbitalë, magnetikë dhe spin. Numri kuantik kryesor n përcakton energjinë e elektronit për energji
Konfigurimet (formula) elektronike të elementeve
Regjistrimi i shpërndarjes së elektroneve në një atom nëpër nivele, nënnivele dhe orbitale quhet konfigurimi elektronik (formula) e një elementi. Zakonisht formula elektronike jepet për kryesoren
Rendi i mbushjes së niveleve, nënniveleve dhe orbitaleve me elektrone në atomet shumëelektronike
Sekuenca e mbushjes së niveleve, nënniveleve dhe orbitaleve me elektrone në atomet multielektronike përcaktohet nga: 1) parimi i energjisë më të ulët; 2) sundimi i Klechkovsky; 3)
Familjet elektronike të elementeve
Varësisht se cili nënnivel mbushet i fundit me elektrone, të gjithë elementët ndahen në katër lloje - familje elektronike: 1. s - elemente; e mbushur me elektrone s -
Koncepti i analogëve elektronikë
Atomet e elementeve me të njëjtën mbushje të nivelit të jashtëm të energjisë quhen analoge elektronike. Për shembull:
Ligji periodik dhe sistemi periodik i elementeve D.I. Mendelejevi
Ngjarja më e rëndësishme në kiminë e shekullit të 19-të ishte zbulimi i ligjit periodik, i bërë në 1869 nga shkencëtari i shkëlqyer rus D.I. Mendeleev. Ligji periodik në formulimin e D. I. Mendeleev thotë
Struktura e sistemit periodik të elementeve kimike nga D. I. Mendeleev
Elementet në tabelën periodike janë renditur në rendin e rritjes së numrave serialë Z nga 1 në 110. Numri serial i një elementi Z korrespondon me ngarkesën e bërthamës së atomit të tij, si dhe me numrin d
Sistemi periodik D.I. Mendelejevi dhe struktura elektronike e atomeve
Le të shqyrtojmë marrëdhënien midis pozicionit të një elementi në tabelën periodike dhe strukturës elektronike të atomeve të tij. Çdo element pasues i tabelës periodike ka një elektron më shumë se ai i mëparshmi
Periodiciteti i vetive të elementit
Meqenëse struktura elektronike e elementeve ndryshon periodikisht, vetitë e elementeve të përcaktuara nga struktura e tyre elektronike, si rrezja atomike, energjia, gjithashtu ndryshojnë periodikisht në përputhje me rrethanat.
Teoria e metodës së lidhjes së valencës
Metoda u zhvillua nga W. Heitler dhe J. London. Një kontribut të madh në zhvillimin e saj dhanë edhe J. Slater dhe L. Pauling. Parimet bazë të metodës së lidhjes valente: 1. Lidhja kimike
Lidhja kovalente
Lidhja kimike ndërmjet atomeve e kryer nga elektronet e përbashkëta quhet kovalente. Një lidhje kovalente (do të thotë "veprojnë së bashku") lind për shkak të formimit të një lidhjeje të përbashkët
Ngopja e lidhjes kovalente
Ngopja e një lidhjeje kovalente (aftësitë valore të një atomi, valenca maksimale) karakterizon aftësinë e atomeve për të marrë pjesë në formimin e një numri të caktuar të kufizuar të lidhjeve kovalente.
Drejtimi i lidhjes kovalente
Sipas MBC, lidhjet kimike më të forta lindin në drejtim të mbivendosjes maksimale të orbitaleve atomike. Meqenëse orbitalet atomike kanë një formë të caktuar, maksimumi i tyre
Polariteti dhe polarizimi i një lidhjeje kimike
Një lidhje kovalente në të cilën dendësia e përbashkët e elektroneve (elektronet e përbashkëta, reja e elektroneve lidhëse) është simetrike në lidhje me bërthamat e atomeve që ndërveprojnë quhet
Polariteti molekular (llojet e molekulave kovalente)
Është e nevojshme të dallojmë polaritetin e një molekule nga polariteti i një lidhjeje. Për molekulat diatomike të tipit AB, këto koncepte përkojnë, siç është treguar tashmë në shembullin e molekulës HCl. Në molekula të tilla, aq më e madhe është ndarja
Lidhja jonike
Kur dy atome me elektronegativitet shumë të ndryshëm ndërveprojnë, çifti i përbashkët i elektroneve mund të zhvendoset pothuajse plotësisht në atomin me elektronegativitet më të lartë. Në re
Lidhje metalike
Vetë emri "lidhje metalike" tregon se po flasim për strukturën e brendshme të metaleve. Atomet e shumicës së metaleve në nivelin e jashtëm të energjisë përmbajnë një numër të vogël valence
Hidroksidet
Ndër komponimet shumëelementare, një grup i rëndësishëm përbëhet nga hidroksidet - substanca komplekse që përmbajnë grupe hidroksil OH. Disa prej tyre (hidroksidet bazë) shfaqin vetitë e bazave - N
Acidet
Acidet janë substanca që shpërndahen në tretësira për të formuar kationet e hidrogjenit dhe anionet e mbetjes së acidit (nga pikëpamja e teorisë së shpërbërjes elektrolitike). Klasifikimi i acideve
Bazat
Baza nga pikëpamja e teorisë së disociimit elektrolitik janë substancat që shpërndahen në tretësirë me formimin e joneve hidroksid OH ‾ dhe joneve metalike (me përjashtim të NH4OH
Ligji i parë i termodinamikës
Marrëdhënia midis energjisë së brendshme, nxehtësisë dhe punës përcaktohet nga ligji (ligji) i parë i termodinamikës. Shprehja e saj matematikore është: Q = DU + A, ose për besko
Efekti termik i një reaksioni kimik. Termokimia. Ligji i Hesit
Të gjitha proceset kimike shoqërohen me efekte termike. Efekti termik i një reaksioni kimik është nxehtësia e çliruar ose e përthithur si rezultat i transformimit të substancave fillestare.
Entropia
Nëse një ndikim i jashtëm ushtrohet në sistem, ndryshime të caktuara ndodhin në sistem. Nëse, pas heqjes së këtij ndikimi, sistemi mund të kthehet në gjendjen e tij origjinale, atëherë procesi është
Energjia e lirë e Gibbs
Të gjitha reaksionet kimike zakonisht shoqërohen nga një ndryshim në entropinë dhe entalpinë. Lidhja ndërmjet entalpisë dhe entropisë së një sistemi krijohet nga funksioni i gjendjes termodinamike, i cili quhet
Energjia e lirë e Helmholcit
Drejtimi i proceseve izokorik (V = konst dhe T = konst) përcaktohet nga ndryshimi i energjisë së lirë të Helmholcit, i cili quhet edhe potenciali izokorik-izotermik (F): DF =
Ligji i veprimit masiv
Varësia e shpejtësisë së një reaksioni kimik nga përqendrimi i reaktantëve përcaktohet nga ligji i veprimit të masës. Ky ligj u krijua nga shkencëtarët norvegjezë Guldberg dhe Waage në vitin 1867. Ai formuloi
Varësia e shpejtësisë së një reaksioni kimik nga temperatura
Varësia e shpejtësisë së një reaksioni kimik nga temperatura përcaktohet nga rregulli Van't Hoff dhe ekuacioni Arrhenius. Rregulli i Van't Hoff: për çdo 1 rritje të temperaturës
Substancat fillestare Komplekse të aktivizuara Produktet e reagimit
Për të formuar një kompleks aktiv, është e nevojshme të kapërcehet një pengesë e caktuar energjetike, duke shpenzuar energji EA. Kjo energji është energjia e aktivizimit - një sasi e tepërt e energjisë, krahasuar
Ndikimi katalizator
Një ndryshim në shpejtësinë e një reaksioni nën ndikimin e shtesave të vogla të substancave të veçanta, sasia e të cilave nuk ndryshon gjatë procesit, quhet katalizë. Substancat që ndryshojnë shpejtësinë e kimisë
Konceptet e përgjithshme të ekuilibrit kimik. Konstanta e ekuilibrit kimik
Reaksionet kimike, si rezultat i të cilave të paktën një nga substancat fillestare konsumohet plotësisht, quhen të pakthyeshme, duke vazhduar deri në përfundim. Megjithatë, shumica e reagimeve janë
Zhvendosja e ekuilibrit kimik. Parimi i Le Chatelier
Ekuilibri kimik mbetet i pandryshuar për sa kohë që parametrat në të cilët vendoset janë konstante.
Ekuilibri fazor. Rregulli i fazës Gibbs
Ekulibrat heterogjenë që lidhen me kalimin e një substance nga një fazë në tjetrën pa ndryshuar përbërjen kimike quhen ekuilibra fazor. Këto përfshijnë ekuilibrat në proceset e avullimit
Çdo gjë në botë është e përbërë nga atome. Por nga erdhën dhe nga çfarë përbëhen? Sot ne u përgjigjemi këtyre pyetjeve të thjeshta dhe themelore. Në fund të fundit, shumë njerëz që jetojnë në planet thonë se nuk e kuptojnë strukturën e atomeve nga të cilat përbëhen vetë.
Natyrisht, lexuesi i dashur e kupton që në këtë artikull ne përpiqemi të paraqesim gjithçka në nivelin më të thjeshtë dhe më interesant, kështu që nuk e “ngarkojmë” me terma shkencorë. Ata që duan ta studiojnë këtë çështje në një nivel më profesional, këshillohen të lexojnë literaturë të specializuar. Megjithatë, informacioni në këtë artikull mund të shërbejë mirë në studimet tuaja dhe thjesht t'ju bëjë më erudit.
Një atom është një grimcë e një substance me madhësi dhe masë mikroskopike, pjesa më e vogël e një elementi kimik, i cili është bartës i vetive të tij. Me fjalë të tjera, është grimca më e vogël e një substance që mund të hyjë në reaksione kimike.
Historia dhe struktura e zbulimit
Koncepti i një atomi ishte i njohur që në Greqinë e Lashtë. Atomizmi është një teori fizike që thotë se të gjitha objektet materiale janë të përbëra nga grimca të pandashme. Së bashku me Greqinë e Lashtë, ideja e atomizmit u zhvillua paralelisht edhe në Indinë e Lashtë.
Nuk dihet nëse alienët u treguan filozofëve të asaj kohe për atomet, apo nëse ata dolën vetë me të, por kimistët ishin në gjendje ta konfirmonin eksperimentalisht këtë teori shumë më vonë - vetëm në shekullin e shtatëmbëdhjetë, kur Evropa doli nga humnera e inkuizicionit dhe mesjetës.
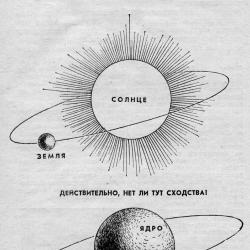
Për një kohë të gjatë, ideja mbizotëruese e strukturës së atomit ishte ideja e tij si një grimcë e pandashme. Fakti që atomi mund të ndahet ende u bë i qartë vetëm në fillim të shekullit të njëzetë. Rutherford, falë eksperimentit të tij të famshëm me devijimin e grimcave alfa, mësoi se atomi përbëhet nga një bërthamë rreth së cilës rrotullohen elektronet. U miratua modeli planetar i atomit, sipas të cilit elektronet rrotullohen rreth bërthamës, si planetët e sistemit tonë diellor rreth një ylli.

Idetë moderne rreth strukturës së atomit kanë përparuar shumë. Bërthama e një atomi, nga ana tjetër, përbëhet nga grimca nënatomike, ose nukleone - protone dhe neutrone. Janë nukleonet që përbëjnë pjesën më të madhe të atomit. Për më tepër, protonet dhe neutronet gjithashtu nuk janë grimca të pandashme, dhe përbëhen nga grimca themelore - kuarke.
Bërthama e një atomi ka një ngarkesë elektrike pozitive, dhe elektronet që rrotullohen në orbitë kanë një ngarkesë negative. Kështu, atomi është elektrikisht neutral.
Më poshtë japim një diagram elementar të strukturës së atomit të karbonit.

Vetitë e atomeve
Pesha
Masa e atomeve zakonisht matet në njësi të masës atomike - a.m.u. Një njësi e masës atomike është masa e 1/12 e një atomi karboni që qëndron lirisht në gjendjen e tij bazë.
Në kimi, koncepti përdoret për të matur masën e atomeve "mole". 1 mol është sasia e substancës që përmban një numër atomesh të barabartë me numrin e Avogadros.
Madhësia
Madhësitë e atomeve janë jashtëzakonisht të vogla. Pra, atomi më i vogël është atomi i Heliumit, rrezja e tij është 32 pikometra. Atomi më i madh është atomi i ceziumit, i cili ka një rreze prej 225 pikometra. Parashtesa pico do të thotë dhjetë në fuqinë minus të dymbëdhjetë! Kjo do të thotë, nëse zvogëlojmë 32 metra me një mijë miliardë herë, marrim madhësinë e rrezes së një atomi të heliumit.
Në të njëjtën kohë, shkalla e gjërave është e tillë që, në fakt, atomi është 99% bosh. Bërthama dhe elektronet zënë një pjesë jashtëzakonisht të vogël të vëllimit të saj. Për qartësi, merrni parasysh këtë shembull. Nëse imagjinoni një atom në formën e stadiumit olimpik në Pekin (ose ndoshta jo në Pekin, thjesht imagjinoni një stadium të madh), atëherë bërthama e këtij atomi do të jetë një qershi e vendosur në qendër të fushës. Orbitat e elektroneve do të ishin diku në nivelin e tribunëve të sipërme dhe qershia do të peshonte 30 milionë tonë. Impresionuese, apo jo?

Nga vijnë atomet?
Siç e dini, atome të ndryshme tani janë grupuar në tabelën periodike. Ai përmban 118 (dhe nëse me elementë të parashikuar, por ende të pa zbuluar - 126) elementë, pa llogaritur izotopet. Por nuk ishte gjithmonë kështu.

Në fillim të formimit të Universit, nuk kishte atome, dhe aq më tepër, kishte vetëm grimca elementare që ndërvepruan me njëra-tjetrën nën ndikimin e temperaturave të mëdha. Siç do të thoshte një poet, ishte një apoteozë e vërtetë grimcash. Në tre minutat e para të ekzistencës së Universit, për shkak të uljes së temperaturës dhe koincidencës së një grupi të tërë faktorësh, filloi procesi i nukleosintezës parësore, kur elementët e parë u shfaqën nga grimcat elementare: hidrogjeni, heliumi, litiumi dhe deuterium (hidrogjen i rëndë). Nga këta elementë u formuan yjet e parë, në thellësi të të cilave u zhvilluan reaksione termonukleare, si rezultat i të cilave hidrogjeni dhe heliumi "u dogjën", duke formuar elementë më të rëndë. Nëse ylli ishte mjaft i madh, atëherë ai i dha fund jetës së tij me një të ashtuquajtur shpërthim "supernova", si rezultat i të cilit atomet u hodhën në hapësirën përreth. Kështu doli i gjithë sistemi periodik.

Pra, mund të themi se të gjithë atomet nga të cilët përbëhemi dikur ishin pjesë e yjeve të lashtë.
Pse nuk prishet bërthama e një atomi?
Në fizikë, ekzistojnë katër lloje të ndërveprimeve themelore midis grimcave dhe trupave që ato përbëjnë. Këto janë ndërveprime të forta, të dobëta, elektromagnetike dhe gravitacionale.
Është falë ndërveprimit të fortë, i cili manifestohet në shkallën e bërthamave atomike dhe është përgjegjës për tërheqjen midis nukleoneve, që atomi është një "arrë e fortë për t'u çarë".
Jo shumë kohë më parë, njerëzit kuptuan se kur bërthamat e atomeve u ndanë, u lëshua një energji e madhe. Ndarja e bërthamave të rënda atomike është burimi i energjisë në reaktorët bërthamorë dhe armët bërthamore.

Pra, miq, pasi ju njohëm me strukturën dhe bazat e strukturës së atomit, ne vetëm mund t'ju kujtojmë se jemi gati t'ju vijmë në ndihmë në çdo kohë. Nuk ka rëndësi nëse ju duhet të përfundoni një diplomë në fizikën bërthamore, apo testin më të vogël - situatat janë të ndryshme, por ka një rrugëdalje nga çdo situatë. Mendoni për shkallën e Universit, porositni punë nga Zaochnik dhe mbani mend - nuk ka arsye për t'u shqetësuar.
Koncepti i "atomit" (i pandashëm) u prezantua nga filozofët e lashtë grekë në 500-200 pas Krishtit. para Krishtit. për të përshkruar strukturën e botës përreth. Deri në fund të shekullit të 19-të, besohej se atomi ishte grimca më e thjeshtë e pandashme. Supozimet e para në lidhje me kompleksitetin e strukturës së atomit u shfaqën në studimin e radioaktivitetit, proceseve elektrokimike, rrezeve katodike dhe fenomeneve të tjera. Më vonë u zbulua se radioaktiviteti është një rrymë grimcash: α - He 2+ bërthama, β - elektrone dhe γ - rrezatim me rreze X.
12.1.1 Modeli i atomit të Radhërfordit
E. Rutherford në 1911–1913 studioi kalimin e grimcave α nëpër fletë metalike (ari). Thelbi i eksperimentit është paraqitur në figurën 12.1.
Figura 12.1 – Kalimi i grimcave α nëpër fletë metalike
Doli se shumica e grimcave α (atomi i heliumit i dyfishtë i jonizuar He +2) kaluan nëpër fletë metalike dhe nuk u devijuan, por vetëm një pjesë e vogël ndryshoi drejtim dhe madje u hodh në drejtim të kundërt. Bazuar në këtë, u arrit në përfundimin se në një pjesë shumë të vogël të vëllimit të atomit ekziston një grimcë e ngarkuar pozitivisht me një masë të madhe, duke u përplasur me të cilën grimca α ndryshoi drejtimin e lëvizjes.
Bazuar në të dhënat eksperimentale të marra, E. Rutherford propozoi një model të atomit, sipas të cilit atomi përbëhet nga një bërthamë e ngarkuar pozitivisht, që zë një vëllim të vogël në të cilin është përqendruar pjesa më e madhe e atomit, dhe grimcat e lehta të ngarkuara negativisht - elektronet. . Një sistem i tillë mund të jetë i qëndrueshëm me kusht që elektronet të rrotullohen rreth bërthamës dhe forca centrifugale e rrotullimit të elektroneve duhet të jetë e barabartë me tërheqjen elektrostatike të elektroneve në bërthamë. Ky model, për analogji me sistemin diellor, u quajt planetar.
Modeli i atomit i Rutherford, megjithë mangësitë e tij, për herë të parë dha një ide të saktë të strukturës së përgjithshme të atomit, por nuk mund të shpjegonte sa vijon:
1) qëndrueshmëria e sistemit bërthamë-elektron. Kur lëviz rreth bërthamës, elektroni duhet të lëshojë vazhdimisht energji, gjë që do të çojë në një ulje të rrezes së orbitës së elektronit dhe në fund të fundit elektroni duhet të bjerë në bërthamë. Në fakt, në mungesë të ndikimit të jashtëm, atomi nuk rrezaton energji;
2) natyra e linjës së spektrit të atomeve. Sipas modelit të propozuar, rrezja e orbitës së elektronit duhet të ulet vazhdimisht, gjë që duhet të çojë në një spektër të vazhdueshëm. Por studimi i spektrave të atomeve tregoi se ato janë të një natyre vijore. Ky fakt tregon se elektronet emetojnë dhe thithin energji jo vazhdimisht, por në pjesë të veçanta ("kuanta").
Fizikani danez Niels Bohr ishte në gjendje t'i eliminonte këto kontradikta.
Modeli i atomit i Bohr-it
Në vitin 1900, Max Planck tregoi se energjia e rrezatimit elektromagnetik në pjesën e dukshme të spektrit është e kuantizuar, d.m.th. drita emetohet dhe absorbohet jo vazhdimisht, por në pjesë të veçanta - kuante. Energjia e kuanteve (E) lidhet me frekuencën e rrezatimit (υ) me formulën e mëposhtme:
ku h është konstanta e Plankut.
Bazuar në teorinë kuantike të rrezatimit, Niels Bohr arriti në përfundimin se një elektron në një atom mund të marrë jo ndonjë, por vlerë të përcaktuar rreptësisht të energjisë. Kalimi i një elektroni nga një nivel energjie në tjetrin shoqërohet me emetimin ose thithjen e një sasie të caktuar rrezatimi elektromagnetik.
Bazuar në teorinë kuantike të rrezatimit dhe modelin planetar të atomit sipas Rutherford, Bohr propozoi një model të atomit, i cili bazohej në postulatet e mëposhtme:
1) një elektron në një atom mund të rrotullohet rreth bërthamës jo në asnjë, por vetëm në orbita të përcaktuara rreptësisht, të cilat quhen të palëvizshme;
2) duke lëvizur në orbita të palëvizshme, elektroni nuk lëshon energji;
3) kur lëviz nga një orbitë më e ulët në një orbitë më të lartë, një elektron thith energji të barabartë me diferencën e energjisë midis orbitave përkatëse. Kjo gjendje e elektronit quhet e ngacmuar. Ai qëndron në këtë gjendje për rreth 10-8 sekonda dhe, pasi lëshon energji të tepërt, kthehet në një orbitë të palëvizshme.
Informacioni për gjendjen e elektroneve në një atom jepet nga spektrat e tranzicioneve elektronike, të cilat, në varësi të metodës së hulumtimit, ndahen në spektra të absorbimit dhe të emetimit (spektri i emetimit). Në mënyrë figurative, mund të themi se spektri është një pasqyrë e gjendjeve elektronike. Aparati matematikor i propozuar nga Bohr bëri të mundur llogaritjen e spektrit vetëm të atomit të hidrogjenit dhe atomeve të ngjashme me hidrogjenin.
Disavantazhet kryesore të modelit të atomit të Bohr:
1) modeli nuk ishte i zbatueshëm për të përshkruar spektrat e atomeve më komplekse se hidrogjeni;
2) modeli nuk mund të shpjegonte intensitetet e ndryshme të vijave spektrale në spektrin e një atomi hidrogjeni.
12.2 Idetë moderne rreth strukturës së atomit
Në vitin 1924, Louis de Broglie sugjeroi që çdo grimcë materiale lëvizëse, përfshirë elektronet, duhet të ketë veti valore.
Duke kombinuar ekuacionet e M. Planck (E = h ν) dhe A. Einstein (E = mc 2), ai nxori një ekuacion për llogaritjen e gjatësisë valore të rrezatimit të çdo grimce lëvizëse
ku h është konstanta e Planck,
m është masa e grimcës, V është shpejtësia e lëvizjes së saj.
Deri në vitin 1927, vetitë valore të elektronit u konfirmuan eksperimentalisht (difraksioni dhe ndërhyrja e elektroneve). Kjo do të thotë, për të përshkruar gjendjen e një elektroni në një atom, është e nevojshme të merren parasysh vetitë e tij valore. Prandaj, mund të flasim për probabilitetin e gjetjes së një elektroni në një rajon të caktuar të hapësirës. Me këtë në mendje, termi "orbitë" u zëvendësua me termin "orbital".
Orbitale– sipërfaqja kufitare brenda së cilës probabiliteti për të gjetur një elektron është 90%.
Në vitin 1925, fizikani austriak Schrödinger propozoi të përshkruante gjendjen e një elektroni në një atom duke përdorur një ekuacion matematikor (ekuacioni Schrödinger), i cili merr parasysh vetitë valore të elektronit. Ky ekuacion është i zbatueshëm për të përshkruar strukturën elektronike në një atom të çdo elementi. Zgjidhja e këtij ekuacioni tregon se gjendja e një elektroni në një atom mund të përshkruhet me katër numra kuantikë: kryesor, orbital, magnetik dhe spin.
Numri kuantik kryesor (n) karakterizon rrezen dhe energjinë e elektronit në nivelin e energjisë. Mund të marrë vlera të plota: 1, 2, 3, 4, etj. Sa më i madh n, aq më i madh është rrezja dhe energjia e elektronit.
Numri kuantik orbital (l) karakterizon energjinë e një elektroni në një nënnivel dhe formën e resë elektronike. Ai pranon vlera të plota nga 0 në (n – 1). Për shembull, nëse numri kuantik kryesor n = 4, atëherë numri kuantik orbital mund të marrë këto vlera: 0; 1; 2; 3. Këto vlera kanë emërtime të shkronjave, përkatësisht: retë elektronike s-, p-, d- dhe f.
Numri kuantik magnetik (m) tregon numrin e orbitaleve në një nënnivel dhe merr vlera të plota nga –l në +l (gjithsej 2l + 1 vlera). Ka 1, 3, 5 dhe 7 orbitale në nënnivelet s-, p-, d- dhe f, respektivisht.
Numri kuantik spin (ms) karakterizon lëvizjen e duhur të një elektroni dhe mund të marrë dy vlera: +1/2 dhe –1/2, domethënë dy elektrone mund të jenë në një orbitale.
Parimet e mbushjes së predhave elektronike të atomeve:
parimi i minimumit të energjisë - mbushja e orbitaleve ndodh në mënyrë të rritjes së energjisë;
Parimi i Paulit - në një atom nuk mund të ketë dy elektrone, katër numrat kuantikë të të cilëve janë të njëjtë;
Rregulli i Hundit - rrotullimi brenda një nënniveli duhet të jetë maksimal.
Tabela 12.1 tregon vlerat e të katër numrave kuantikë dhe numrin maksimal të orbitaleve dhe elektroneve në nivelet dhe nënnivelet e energjisë.
Tabela 12.1 - Vlerat e n, l, m, numri i orbitaleve në nënnivele
(2l + 1), elektronet në nënnivele (N l) dhe nivele (N n)
| n | l | m | 2l + 1 | Nl = 2 (2l+1) | Nn=2n2 | ||
| 0(s) | |||||||
| 0(s) | |||||||
| 1 (p) | – 1,0,+1 | ||||||
| 0(s) | |||||||
| 1 (p) | – 1,0,+1 | ||||||
| 2(d) | – 3, – 2, – 1,0,+1,+2 | ||||||
| 0(s) | |||||||
| 1 (p) | – 1, 0, +1 | ||||||
| 2(d) | – 2, – 1, 0, +1, +2 | ||||||
| 3 (f) | – 3, – 2, – 1,0,+1,+2,+3 | ||||||
Për të përshkruar gjendjen e elektroneve në një atom përdoren: formula elektronike, diagrami i energjisë, modeli gjeometrik.
Formula elektronike tregon shpërndarjen e elektroneve mbi
nivelet dhe nënnivelet e energjisë. Për shembull:
Për elementin e oksigjenit (O) me numër atomik 8 – 1s 2 2s 2 2p 4,
Për elementin e kromit (Cr) me numër atomik 24 – 1s 2 2s 2 2p 6 3s 2 3p 6 3d 4 4s 2 , duke marrë parasysh rrjedhjen e elektroneve, formula elektronike është 1s 2 2s 2 2p 6 3s 2 3p 6 4 3d 1 . Rrjedhja e elektroneve shpjegohet me faktin se nënnivelet gjysmë ose plotësisht të mbushura (p 3, p 6, d 5, d 10, f 7, f 14) karakterizohen nga qëndrueshmëri e shtuar.
Diagrami i energjisë tregon grafikisht shpërndarjen e elektroneve nëpër qelizat energjetike (orbitalet). Shigjeta në mënyrë konvencionale tregon një elektron dhe spinin e tij. Figura 12.2 tregon diagramin energjetik të atomit të oksigjenit.

Figura 12.2 – Diagrami energjetik i atomit të oksigjenit
Modeli gjeometrik tregon format e orbitaleve dhe vendndodhjen e tyre në hapësirë. Figura 12.3 tregon modelin gjeometrik të atomit të oksigjenit.

Figura 12.3 – Modeli gjeometrik i atomit të oksigjenit
Formula elektronike e një elementi mund të shkruhet në bazë të pozicionit të tij në tabelën periodike, pasi periodiciteti i ndryshimeve në vetitë e elementeve në tabelë është pasojë e periodicitetit të mbushjes së niveleve të energjisë dhe nënnivelet e atomeve me elektrone.
Ligji periodik dhe tabela periodike D.I. Mendelejevi
DI. Mendeleev, duke krahasuar ndryshimet në masat atomike të elementeve dhe vetitë e tyre kimike, zbuloi ligjin periodik:
"Vetitë e trupave të thjeshtë, si dhe format dhe vetitë e përbërjeve të elementeve, varen periodikisht nga madhësia e peshave atomike të elementeve."
Në përputhje me idetë moderne për strukturën e atomeve, karakteristika kryesore e çdo elementi është ngarkesa e bërthamës së tij, prandaj formulimi modern i ligjit periodik duket si:
"Vetitë e elementeve, si dhe vetitë dhe forma e përbërjeve që ata formojnë, varen periodikisht nga ngarkesat e bërthamave të atomeve të tyre."
Një pasqyrim i ligjit periodik është tabela periodike e elementeve, të cilën D.I. Mendeleev e përpiloi në vitin 1869. Ai përfshin periudha dhe grupe.
Periudha – rreshti horizontal i elementeve. Ka shtatë periudha në tabelën periodike. Elementet f (lantanide dhe aktinide) renditen në dy rreshta të veçantë. Në periudha, rrezet e atomeve zvogëlohen.
Grupi – rresht vertikal të elementeve. Grupet ndahen në nëngrupe kryesore dhe dytësore. Për elementët e nëngrupeve kryesore, niveli i jashtëm i energjisë është i mbushur, dhe për nëngrupet dytësore, niveli i energjisë para-jashtëm është i mbushur. Nëngrupet kryesore përmbajnë metale dhe jometale, dhe nëngrupet dytësore përmbajnë vetëm metale. Plotësimi i nëngrupeve dytësore fillon nga periudha e katërt. Në nëngrupet kryesore, rrezet e atomeve rriten. Në nëngrupet anësore, në përputhje me mbushjen e nënniveleve d- dhe f, tërheqja elektrostatike e elektroneve në bërthamë rritet, si rezultat i së cilës rrezet e atomeve madje mund të ulen. Ky fenomen quhet ngjeshje d- dhe f (lantanide). Ajo çon në një ulje të aktivitetit reduktues dhe një rritje të densitetit të substancës. Për shembull, për nëngrupin e bakrit (Cu, Ag dhe Au), dendësia e këtyre metaleve ka vlerat përkatëse: 8,96, 10,50 dhe 19,3 g∕cm 3.
Elementet që ndodhen në të njëjtin nëngrup kanë veti kimike të ngjashme dhe quhen elemente analoge. Për shembull:
O, S, Se, Te, Po - ndodhen në nëngrupin VI kryesor dhe, në përputhje me rrethanat, janë elementë analogë;
Cr, Mo, W ndodhen në nëngrupin VI anësor dhe janë gjithashtu elementë analogë.
Për të karakterizuar vetitë kimike të atomeve, përdoren sasi të tilla si energjia e jonizimit, energjia e afinitetit të elektroneve dhe elektronegativiteti.
Energjia e jonizimit– është sasia e energjisë e nevojshme për të hequr një elektron nga një atom ose jon i pangacmuar. Energjitë e dytë dhe të mëvonshme të jonizimit janë heqja e elektroneve nga jonet e ngarkuar pozitivisht. Energjia e jonizimit përcakton vetitë reduktuese të elementeve.
Energjia e afinitetit të elektroneve – është sasia e energjisë që çlirohet ose absorbohet kur një elektron i shtohet një atomi neutral. Sa më e lartë të jetë energjia e afinitetit të elektronit të një atomi, aq më i fortë është agjenti oksidues. Metalet nuk kanë afinitet elektronik.
Elektronegativiteti (EO) –kjo është një vlerë që merret parasysh
aftësia e atomeve për të tërhequr dhe humbur elektrone. Elektronegativiteti relativ i litiumit supozohej në mënyrë konvencionale të jetë i barabartë me unitetin, dhe elektronegativitetet e elementeve të mbetur u gjetën në lidhje me të. Kur lëvizni nga elementi më pak elektronegativ - Fr në elementin më elektronegativ - F, elektronegativiteti rritet dhe, në përputhje me rrethanat, vetitë metalike dobësohen dhe vetitë jometalike rriten. Besohet se 22 elementë janë jometale dhe pjesa tjetër janë metale.
Në tabelën periodike, në periudha dhe grupe, vetitë e elementeve ndryshojnë natyrshëm, kështu që vetitë e çdo elementi janë afër vlerave mesatare aritmetike të vetive të elementeve midis të cilëve ndodhet elementi i analizuar.